
Tabla periódica y tendencias periódicas (Selección múltiple)
Price: 5



Tabla periódica y tendencias periódicas (Selección múltiple)
Price: 5
Escritura para primer ciclo
Price: 21

Lectura para primer ciclo
Price: 21

Diferencia entre el "some" y el "any"
Price: 12




| Resource type | Lesson |
| Recommended age | 4 - 18 years |
| File information | pptx, 10 pages, 3.25 MB |


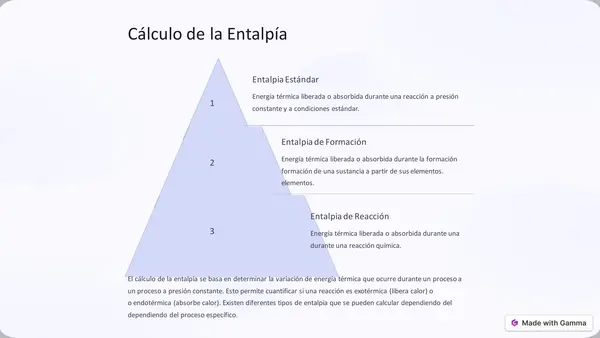

| Resource type | Lesson |
| Recommended age | 4 - 18 years |
| File information | pptx, 10 pages, 4.61 MB |
There are no comments yet, write one yourself!
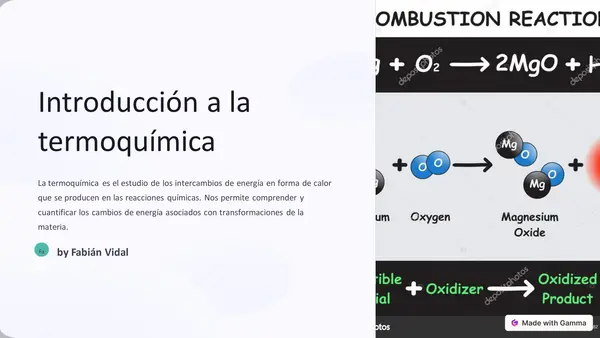



| Resource type | Lesson |
| Recommended age | 4 - 18 years |
| File information | pptx, 10 pages, 6.09 MB |
There are no comments yet, write one yourself!

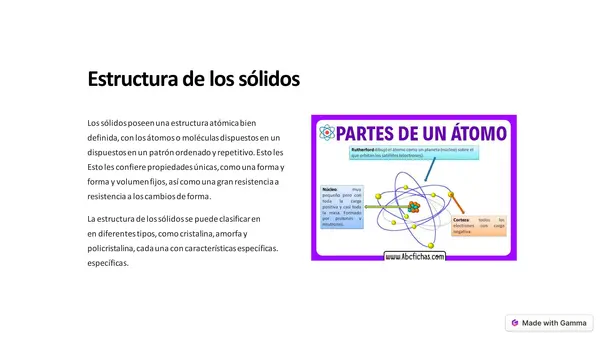


| Resource type | Lesson |
| Recommended age | 4 - 18 years |
| File information | pptx, 10 pages, 2.51 MB |
There are no comments yet, write one yourself!
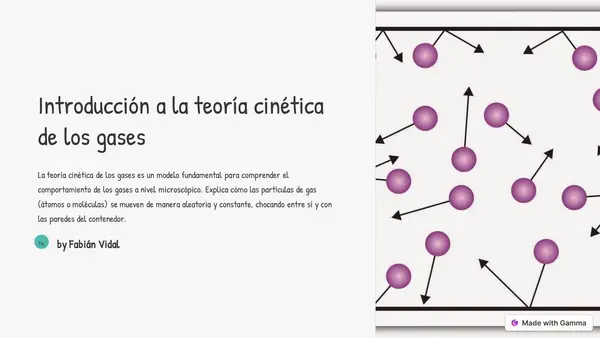
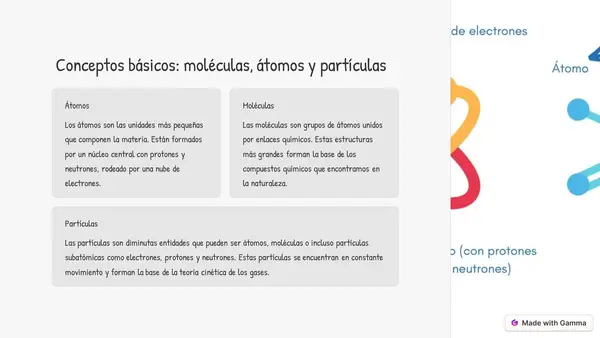


| Resource type | Lesson |
| Recommended age | 4 - 18 years |
| File information | pptx, 10 pages, 2.46 MB |
There are no comments yet, write one yourself!


| Resource type | Assessment |
| Recommended age | 4 - 18 years |
| File information | pdf, 3 pages, 180 KB |
There are no comments yet, write one yourself!


| Resource type | Assessment |
| Recommended age | 4 - 18 years |
| File information | pdf, 3 pages, 180 KB |
There are no comments yet, write one yourself!


| Resource type | Assessment |
| Recommended age | 4 - 18 years |
| File information | pdf, 3 pages, 179 KB |
There are no comments yet, write one yourself!


| Resource type | Assessment |
| Recommended age | 4 - 18 years |
| File information | pdf, 3 pages, 187 KB |
There are no comments yet, write one yourself!


| Resource type | Assessment |
| Recommended age | 4 - 18 years |
| File information | pdf, 3 pages, 185 KB |
There are no comments yet, write one yourself!
There are no comments yet, write one yourself!